CANCÉRISATION: DESTABILISATION DE L'ADN
Au cours de la cancérisation, les cellules prolifèrent avec une rapidité inusitée
et de façon
anarchique; elles se mettent également à produire des molécules qu'elles ne
synthétisent pas
d'ordinaire, ce qui traduit une anomalie dans l'activation des gènes. Comment rendre
compte,
au niveau de 1'ADN, de ces propriétés anormales ?
Dans le contexte des théories en cours, il semblait évident de les expliquer par une
mutation.
Pourtant, l'analyse comparative des séquences nucléotidiques d'ADN sains et cancéreux
correspondants, à laquelle les avancées techniques conféraient une précision
croissante, ne
mettait pas en évidence l' existence constante de différences significatives entre les
structures
primaires de ces ADN.
Comment, de plus, ne pas s'étonner que dans le test d'Ames, où entre bien en jeu une
mutation
(mais pas une cancérisation), des molécules de nature chimique complètement différente
puissent causer une mutation identique, tandis que d'autres, pourtant cancérogènes chez
l'animal, ne sont pas mutagènes ?
Le problème devait être abordé d'une manière fondamentalement différente.
A la suite de l'élucidation de la structure de 1'ADN, près de trente ans de
recherches dans les
laboratoires du monde entier n'avaient pas suffi à percer tous les secrets de la
multiplication et
de la différenciation cellulaires, qui sont encore loin d'être entièrement éclaircis
aujourd'hui. I1
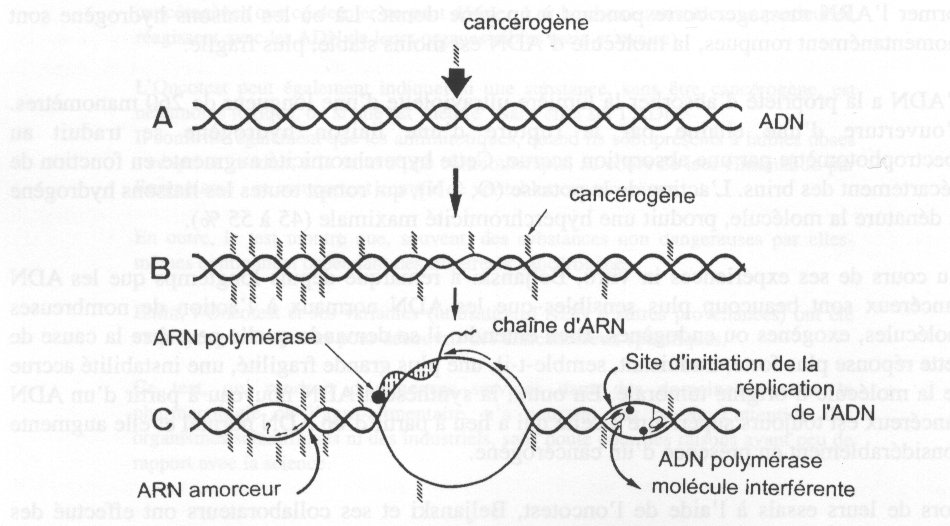
avait néanmoins été montré qu'au moment de la réplication de 1'ADN, ses deux brins
doivent
s'écarter l'un de l'autre. A ce moment, les liaisons hydrogène qui les attachent l'un à
l'autre se
rompent. La châîne s'ouvre localement, ce qui permet à 1'ADN polymérase d'avoir accès
aux
sites d' initiation, à partir desquels se fait la synthèse d' un nouveau segment d' ADN.
De même,
pour rendre possible la synthèse des produits cellulaires, les brins de la chaîne d'ADN
doivent
aussi s'écarter en certains points, de façon transitoire, pour que 1'ARN polymérase
puisse
former 1'ARN messager correspondant à un gène donné. Là où les liaisons hydrogène
sont
momentanément rompues, la molécule d'ADN est moins stable, plus fragile.
L'ADN a la propriété d' absorber la lumière ultraviolette d'une longueur de 260
manomètres.
L'ouverture d'une chaîne par la rupture d'une liaison hydrogène se traduit au
spectrophotomètre par une absorption accrue. Cette hyperchromicité augmente en fonction
de
l'écartement des brins. L' action de la potasse (O. 1 N), qui rompt toutes les liaisons
hydrogène
et dénature la molévule, produit une hyperchromicité maximale (45 à 55 %).
Au cours de ses expériences in vitro, Beljanski a remarqué depuis longtemps que les
ADN
cancéreux sont beaucoup plus sensibles que les ADN normaux à l'action de nombreuses
molécules, exogènes ou endogènes. Bien entendu, il se demande quelle peut être la
cause de
cette réponse plus forte, traduisant, semble-t-il, une plus grande fragilité, une
instabilité accrue
de la molécule d'origine tumorale. En outre, la synthèse d'ADN nouveau à partir d'un
ADN
cancéreux est toujours supérieure à celle qui a lieu à partir d'un ADN normal et elle
augmente
considérablement en présence d'un cancérogène.
Lors de leurs essais à l'aide de l'oncotest, Beljanski et ses collaborateurs ont
effectué des
mesures de contrôle au spectrophotomètre, en vue de confirmer par un moyen
supplémentaire
la réalité de la différence d' action des cancérogènes sur les ADN normaux et
cancéreux, de la
"reconnaissance" de 1'ADN tumoral par ces substances, qui en intensifient
spécifiquement la
réplication. Ils constatent que tous les cancérogènes testés augmentent fortement
l'absorption
à 260 nm des ADN cancéreux et très peu celle des ADN normaux. Ainsi, l'éthionine,
carcinogène puissant, augmente de 10 à 15 % l' absorption à 260 nm des ADN cancéreux
et de
3 % seulement celle des ADN normaux. La potasse, elle, ne fait aucune différence entre
eux:
l'hyperchromicité est la même, que 1'ADN soit normal ou cancéreux.
Les cancérogènes ont donc le pouvoir de rompre des liaisons hydrogène, de rendre
encore
moins stable une molécule qui, parce qu'elle est douée d'une plus forte capacité
intrinsèque de
réplication, devrait se présenter sous forme d'une chaîne plus lâche que 1'ADN normal.
La cellule cancéreuse n'est-elle pas tout simplement, une cellule dont 1'ADN est déstabilisé ?
La différence de comportement entre 1'ADN normal, extrait de tissus sains, et 1'ADN
tumoral,
isolé à partir de tissus cancéreux ne provient-elle pas, justement, de ce nombre accru
de liaisons
hydrogène rompues, de cette déstabilisation ?
Les réflexions, les présomptions, les intuitions accumulées se sont concrétisées
en une vision
d' ensemble. L' ADN déstabilisé peut être répliqué plus intensément parce que de
plus
nombreux sites d' initiation sont accessibles aux enzymes chargées de cette tâche. L'
écartement
local des brins de la chaîne s'accompagne d'un resserrement de l'hélice de part et
d'autre des
sites où les liaisons hydrogène ont été rompues. Le fonctionnement des gènes, qui
dépend de
la facilité avec laquelle les polymérases peuvent y accéder, devient de ce fait
anormal. Les uns
ont une activité exagérée, d'autres sont réduits au silence. Qu'un gène s'exprime
trop
fortement, ou trop longtemps, et son produit apparâît dans la cellule en quantité
excessive;
qu'un gène normalement silencieux soit mis de manière intempestive à la portée des
enzymes
de transcription, et des synthèses imprévues ont lieu;
qu'un gène régulateur ou bien producteur
d'une substance essentielle au maintien des caractères de la cellule se taise, et
celle-ci peut
perdre certains des freins qui lui étaient imposés.
< IMG_P42.JPG >

REPRÉSENTATION SCHÉMATIQUE DE L'OUVERTURE ET DE LA FERMETURE
DES CHAINES D'ADN EN PRÉSENCE D'UN CANCÉROGÈNE.
L'ADN déstabilisé est. une cible de choix pour les innombrables molécules qui, par
leur nature,
ont la capacité de s'y fixer en s'intercalant entre ses brins: cancérogènes,
antibiotiques,
antimitotiques et médicaments divers, pesticides, et, parmi les substances endogènes,
hormones, peptides, acides nucléiques.. . La déstabilisation des ADN cancéreux ouvre la
porte
aux cancérogènes et leur permet de se fixer; elle explique l'attrait privilégié que
les ADN
tumoraux exercent sur ces produits, donnant l'impression que ceux-ci les
"reconnaissent". A
leur tour, les cancérogènes ont la propriété de déstabiliser encore plus 1'ADN
tumoral.
Aucune mutation, c'est-à-dire aucun changement dans la structure primaire de 1'ADN
n'est
nécessaire pour expliquer la cancérisation. I1 arrive cependant que, dans la châîne
déstabilisée,
des brins d'ADN finissent par trop s'écarter l'un de l'autre. Les brins dépareillés
sont beaucoup
plus vulnérables que la double chaîne d'ADN à l' action de molécules qui, comme les
nucléases
ou divers agents chimiques, les coupent, les cassent, provoquant des mutations plus ou
moins
étendues ou bien des délétions, pertes d'un segment entier de gène, qui disparâît ou
migre sur
un chromosome où il n'a pas sa place.
La plupart des antimitotiques, en se fixant sur 1'ADN, cassent les liaisons hydrogène.
Aux
fortes concentrations normalement utilisées en chimiothérapie, ils se comportent en
toxiques
vis-à-vis des cellules en division rapide; en outre, dans ces cellules dont 1'ADN est
déstabilisé
par les processus normaux de la réplication, ils ouvrent la chaîne si fortement, que
tout
fonctionnement coordonné des gènes devient impossible et que la cellule meurt. Ils ont
malheureusement, en général, un effet semblable sur les cellules souches sanguines, qui
sont
en division rapide et où apparaissent, à la longue, des atteintes chromosomiques,
cassures et
délétions. A faibles doses, comme le montre l'Oncotest, ces antimitotiques se comportent
comme de véritables cancérogènes.
Si, par sa présence persistante, un cancérogène parvient à vaincre la résistance
qu'oppose une
cellule saine, il crée le long de 1'ADN normal, en rompant localement des liaisons
hydrogène,
des zones relâchées, plus vulnérables, où vont ensuite pouvoir s'engouffrer et se
fixer d'autres
molécules, exogènes ou endogènes (rappelons que dans l'Oncotest, l'action d'un
cancérogène
sur la réplication d'un ADN normal isolé est peu perceptible, mais n'est pas nulle).
D'abord de
faible amplitude, le processus s'étend de proche en proche, et, au-delà d'un certain
seuil de
déstabilisation, la voie est ouverte à la cancérisation.
Par son action répétée, une polychimiothérapie prolongée peut causer les cancers
secondaires
que l ' on voit apparaître à la suite de certains traitements . Un excès durable d '
hormones
stéroides peut aboutir à une transformation cancéreuse dans leurs organes cibles. De
même, à
la longue, des tissus végétaux sains cultivés in vitro peuvent, sous l'influence des
auxines
ajoutées au milieu de culture, et dont l'Oncotest révèle les potentialités
déstabilisantes, acquérir
certains caractères de tissus tumoraux. Ces tissus sont dits anergiés.
La déstabilisation de 1'ADN est la condition première et déterminante de la
cancérisation. La
déstabilisation des ADN cancéreux est permanente. Les agents capables d'ouvrir les
chaînes
d'ADN sont potentiellement cancérogènes.
Le nouveau modèle biochimique de la cancérisation fournit une explication à bien des
faits qui
restaient obscurs et les relie les uns aux autres. "Une loi générale s'est
dégagée, a écrit
Beljanski. Elle prend essentiellement appui sur l'ensemble de nos propres recherches, mais
trouve une confirmation solide dans de très nombreuses données de la littérature
scientifique,
données éparpillées et parfois sans interprétation possible et qui trouvent maintenant
une
explication rationnelle."
RÉSUMÉ
Les cellules cancéreuses proliferent rapidement, de façon anarchique, et
synthétisent
des produits anormaux. Il était convenu d'attribuer ces anomalies de comportement à
des mutations, qui surviendraient dans la séquence d'un ADN normal pour le
transformer en ADN tumoral. Cependant, de telles mutations ne peuvent être mises
en évidence de manière constante.
Dans une cellule normale, les deux brins qui constituent la double châîne de l'ADN
s'écartent localement, à la suite d'une rupture des liaisons hydrogène, dans deux
circonstances précises: soit au moment où 1'ADN doit être répliqué, soit lorsque
1'ARN messager doit être synthétisé pour permettre l'expression des gènes, c'est-à-
dire la synthèse protéique qui dépend de leur activation spécifique. Quand les
liaisons
hydrogène sont rompues, la molévule d'ADN absorbe plus fortement la lumière UV
de 260 nm (hyperchromicité).
Des mesures spectrophotométriques montrent à Beljanski que, dans les ADN
cancéreux, un grand nombre de liaisons hydrogène sont rompues en permanence. La
molécule est donc fragile, moins stable: elle est déstabilisée.
Là où les brins sont séparés, des sites d'initiation jusqu'alors inutilisés
deviennent
accessibles aux enzymes chargées de la réplication et de l'expression des gènes. Aussi
1'ADN cancéreux se réplique-t-il fortement, mais de façon anarchique, puisque la
déstabilisation désorganise les mécanismes de régulation. D'autre part, à partir des
nouveaux sites d'initiation, des gènes normalement silencieux peuvent être activés et
donner naissance à des produits non synthétisés en temps normal. Enfin, le
relâchement des zones déstabilisées de la double chaîne d'ADN s'accompagne, de
part et d' autre de ces régions, d' un resserrement exagéré qui peut réduire au
silence
des gènes exprimés dans la cellule normale
Sa déstabilisation rend l'ADN cancéreux vulnérable. Des molécules trés diverses
peuvent
venir s'y fixer. Panni celles-ci, il en est qui ont pour effet de briser encore plus les
liaisons
hydrogène, augmentant le nombre des sites d' initiation accessibles aux enzymes de
réplication et de transcription. Ces substances sont potentiellement cancérogènes.
Si, dans l'Oncotest, un cancérogène "reconnaît" 1'ADN tumoral et en
augmente la
réplication, tandis qu'il n'agit pratiquement pas sur 1'ADN normal, c'est parce qu'il
peut se fixer beaucoup plus facilement à la molécule tumorale déstabilisée, dont les
brins isolés l'attirent en quelque sorte.
Beaucoup d'antimitotiques sont des substances capables d'écarter les brins de
1'ADN. Aux doses où ils sont habituellement utilisés en chimiothérapie, ils ouvrent
les chaînes d'ADN si fortement que tout fonctionnement coordonné des gènes
devient impossible; les brins isolés, vulnérables à de nombreuses enzymes, subissent
des cassures, des délétions, des mutations.
Les cellules sanguines normales se multiplient rapidement. Leur ADN, qui est ainsi
plus souvent dans un état de déstabilisation momentanée, subit donc plus facilement
les effets des antimitotiques, ce qui se traduit, à la longue, par des anomalies
chromosomiques .
La présence persistante d' un cancérogène finit par vaincre la résistance d' une
cellule
saine et par créer des zones déstabilisées en permanence le long de son ADN
primitivement normal; cette atteinte est. ensuite facilement amplifiée par toutes sortes
de molécules déstabilisantes.
Une polychimiothérapie prolongée peut ainsi déstabiliser l'ADN de cellules normales
et favoriser la survenue de cancers secondaires. Les hormones stéroides en excès
agissent de la même manière. Chez les végétaux, la présence permanente d'un excès
d' auxine, hormone dont 1' Oncotest révèle le pouvoir déstabilisant, entraîne
l'apparition d'un état précancéreux (tissus anergiés).
La théorie de la déstabilisation de l'ADN permet de relier et d'expliquer quantité
d'observations jusque-là sans interprétation possible.